Energieumwandlung bei chemischen Reaktionen
Was haben chemische Reaktionen bitte mit Energie zu tun? Mehr, als du vielleicht denkst! Jedes Leben auf der Erde existiert zum Beispiel nur, weil unsere Zellen Zucker verbrennen, um dabei Energie zu machen – Energie kommt also frei. Tatsächlich verändert sich bei jeder chemischen Reaktion die Energie. Wie das genau funktioniert, erfährst du hier.

Das Wichtigste auf einen Blick
- Alle chemischen Reaktionen benötigen Aktivierungsenergie, um zu beginnen.
- Wenn bei einer Reaktion Energie frei kommt, nennen wir sie exotherm.
- Das Gegenteil passiert bei einer endothermen Reaktion: Energie wird verbraucht.
- Anhand eines Energiediagramms können wir darstellen, ob eine Reaktion endotherm oder exotherm verläuft.

Aktivierungsenergie
Wenn du eine Kerze in einen Raum stellst, dann sind alle Stoffe da, die für die Reaktion nötig sind: Nämlich Wachs und Sauerstoff. Trotzdem musst du erst mit Hilfe eines Feuerzeuges für die richtige Entzündungstemperatur sorgen, bevor die Kerze anfängt zu brennen. Das ist ein Beispiel für Aktivierungsenergie.
Aktivierungsenergie ist die Energie, die nötig ist, um eine chemische Reaktion überhaupt in Gang zu bringen – sozusagen der „Startschuss“.
Stell dir vor, du willst einen Ball über einen Hügel rollen. Damit er auf der anderen Seite runterrollen kann, musst du ihn erstmal hochschieben – das kostet Kraft. Diese Kraft ist wie die Aktivierungsenergie. Erst wenn der Ball oben ist, rollt er von allein weiter – genau wie eine Reaktion, die nach dem Start von selbst abläuft.
Exotherme Reaktionen
Bei manchen chemischen Reaktionen kommt viel mehr Energie frei, als wir am Anfang reingesteckt haben. Das lässt sich zum Beispiel daran messen, dass Wärme oder Licht entstehen – bei der Verbrennung passiert sogar beides. Solche Reaktionen nennen wir exotherm. Exo bedeutet nämlich „nach außen“: Wärme geht also nach außen. Beispiele für exotherme Reaktionen findet man überall, wie zum Beispiel, wenn Feuerwerke explodieren, oder die Energieverbrennung in den Zellen deines Körpers.


Endotherme Reaktionen
Andere chemische Reaktionen benötigen andauernd Energiezufuhr, um stattfinden zu können. Man nennt sie endotherme Reaktionen. Endotherme Reaktionen benötigen also Energie in Form von Wärme oder Licht, damit sie passieren können. Es ist dann auch nur logisch, dass „endo“ „nach innen“ bedeutet.
Die wohl bekannteste und auch wichtigste endotherme Reaktion der Welt ist die Photosynthese. Dabei wird Sonnenenergie von Pflanzen genutzt, um Zucker herzustellen.
Es ist wichtig, zu verstehen, dass endotherme Reaktionen manchmal auch schon bei Zimmertemperatur stattfinden können – denn auch das ist Energie. Ein Beispiel dafür ist die Reaktion zwischen Essig und Backpulver, die auch bei Zimmertemperatur stattfindet.
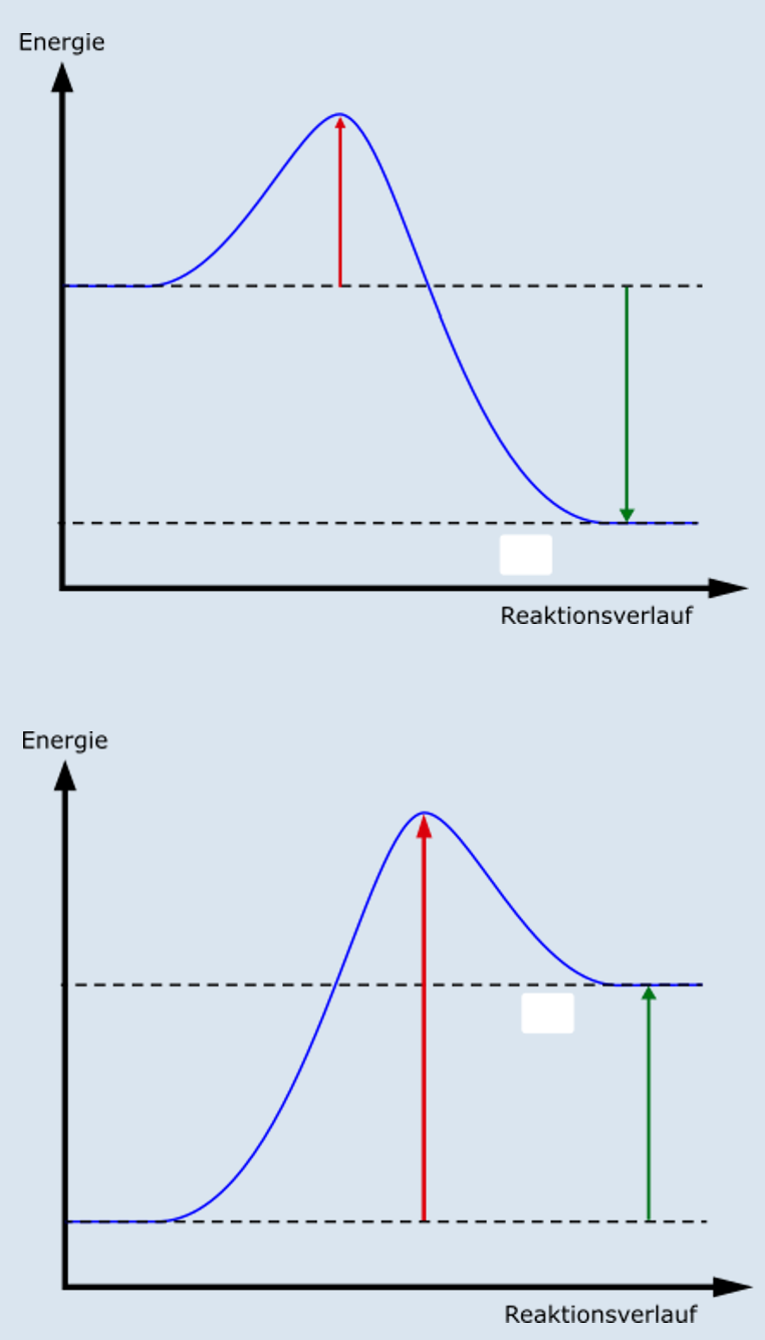
Das Energiediagramm
Um darzustellen, wie die Energie bei einer Reaktion verläuft, benutzen wir in der Chemie das sogenannte Energiediagramm. Energiediagramme zeigen dir das Energielevel von Edukten und Produkten der Reaktion.
Wenn das Energielevel der Edukte höher ist, als das der Produkte, dann ist die Reaktion exotherm. In den Edukten war nämlich mehr Energie, als am Ende in den Produkten ist. Das bedeutet, die Energie ist freigekommen.
Wenn das Energielevel der Edukte niedriger ist als das der Produkte, dann ist die Reaktion endotherm. Das bedeutet nämlich, dass in den Produkten mehr Energie gespeichert ist, als zuerst in den Edukten war, und entsprechend Energie aus der Umgebung verbraucht wurde.